
正大豐海創(chuàng)新藥FHND1002顆粒納入藥審中心“關(guān)愛計(jì)劃”試點(diǎn)項(xiàng)目
發(fā)布時(shí)間:2024-12-02瀏覽次數(shù):
正大豐海創(chuàng)新藥FHND1002顆粒
納入藥審中心“關(guān)愛計(jì)劃”試點(diǎn)項(xiàng)目
為落實(shí)“以患者為中心”的研發(fā)理念,幫助藥企、研究者、監(jiān)管機(jī)構(gòu)更好的傾聽罕見病患者需求,以助力藥物研發(fā)的推進(jìn)和技術(shù)要求的優(yōu)化,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心啟動(dòng)以患者為中心的罕見疾病藥物研發(fā)試點(diǎn)工作,即“關(guān)愛計(jì)劃”(CARE計(jì)劃,patient-Centered Action for Rare diseases Encouragement)。
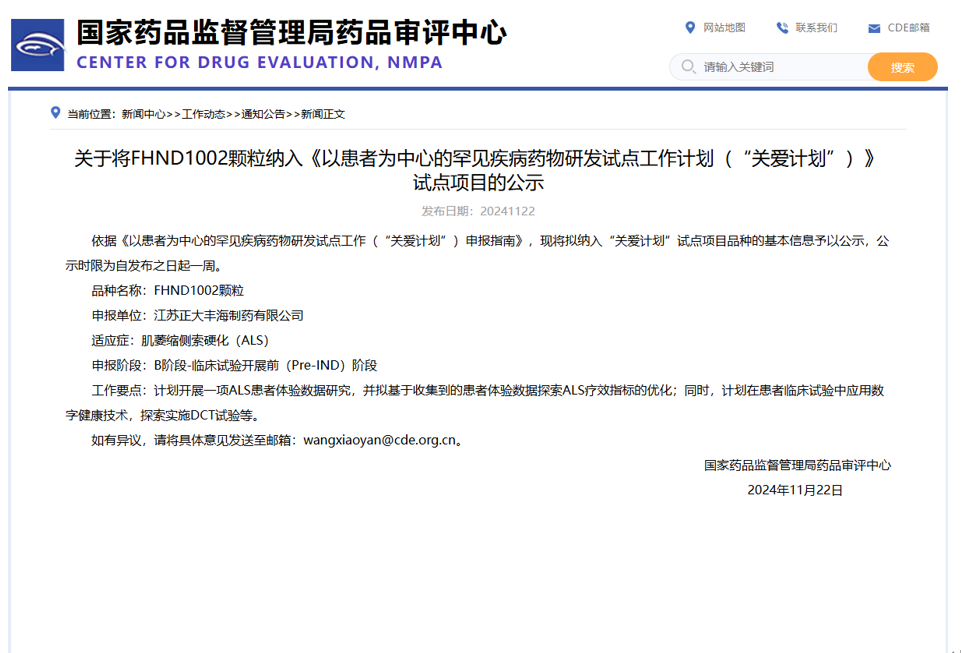
2024年11月22日,藥審中心將正大豐海創(chuàng)新藥FHND1002顆粒納入《以患者為中心的罕見疾病藥物研發(fā)試點(diǎn)工作計(jì)劃(“關(guān)愛計(jì)劃”)》試點(diǎn)項(xiàng)目,正式在藥審中心網(wǎng)站上予以公示,公示無異議的品種最終將被納入“關(guān)愛計(jì)劃”。
FHND1002顆粒是正大豐海自主研發(fā)的一款First-in-Class(全球首創(chuàng))的小分子藥物,擬用于肌萎縮側(cè)索硬化(漸凍癥)等神經(jīng)退行性疾病,其具有全新的靶點(diǎn)、全新作用機(jī)制和全新的化合物結(jié)構(gòu),已于2023年12月獲得肌萎縮側(cè)索硬化適應(yīng)癥的臨床許可,目前正在中國(guó)進(jìn)行1期臨床試驗(yàn)。
根據(jù)試點(diǎn)項(xiàng)目納入標(biāo)準(zhǔn),藥審中心將在五個(gè)申報(bào)階段中,各選擇1-2個(gè)具有代表性的品種納入“關(guān)愛計(jì)劃”。本次正大豐海FHND1002顆粒入選“關(guān)愛計(jì)劃”,代表藥審中心對(duì)FHND1002作用機(jī)制創(chuàng)新性的肯定,更推動(dòng)正大豐海深入了解罕見病患者需求,繼續(xù)全力推進(jìn)FHND1002研發(fā)工作。




 蘇公網(wǎng)安備 32098202000163號(hào)
蘇公網(wǎng)安備 32098202000163號(hào)